Лучшие антидепрессанты при психогенной боли. Депрессия и хроническая боль. Хроническая боль может быть трёх типов
Важнейшей причиной обращения пациентов за медицинской помощью является боль. Она сопутствует большинству заболеваний и патологических состояний. С одной стороны, боль — приспособительная реакция, направленная на мобилизацию защитных сил организма, однако интенсивная острая или хроническая боль сама становится мощным патогенным фактором, приводящим к резкому ограничению активности, нарушению сна, значительно снижая качество жизни пациента.
17-19 мая в г. Ужгороде состоялась VI научно-практическая конференция «Карпатськi читання», в рамках которой была проведена школа клинических нейронаук, посвященная вопросам диагностики и лечения болевых синдромов в неврологии и инсультологии.
С докладом «Постинсультный болевой синдром» выступил В.Н. Мищенко (Институт неврологии, психиатрии и наркологии, г. Харьков).
В современном мире сосудистые заболевания головного мозга — огромная медико-социальная проблема. Это обусловлено высоким уровнем заболеваемости, смертности и инвалидности населения. В структуре сосудистых заболеваний ведущее место принадлежит мозговому инсульту — 150-200 случаев на 100 тысяч населения. Ежегодно около 16 млн больных впервые заболевают мозговым инсультом, а около 7 млн людей умирают вследствие него. Лишь 10-20 % лиц, перенесших инсульт, возвращаются к труду, а 20-43 % больных требуется посторонняя помощь.
Достаточно частое последствие мозгового инсульта — постинсультная боль, которую отмечают от 11 до 53 % пациентов. Самыми распространенными типами хронической боли после инсульта являются костно-мышечная боль — в 40 % случаев, боль в области плечевого сустава — 20 %, головная боль — 10 %, центральная постинсультная боль (ЦПИБ) — 10 %, болезненная спастичность — 7 %.
Центральная постинсультная боль представляет собой болевой синдром, который развивается после острой цереброваскулярной катастрофы. Он характеризуется болью и чувствительными нарушениями в тех частях тела, которые соответствуют области головного мозга, поврежденной сосудистым очагом. Центральную постинсультную боль относят к группе хронических болевых расстройств, которые объединены в понятие «центральная нейропатическая боль» (Henriett K., Nanna B. еt al., 2009).
Центральная нейропатическая боль возникает как прямое следствие повреждения или заболевания, поражающего центральную соматосенсорную систему, а также в результате патологического воздействия на спиноталамокортикальные пути центральной нервной системы.
Наиболее частыми причинами центральной нейропатической боли являются: ишемический и геморрагический инсульты, рассеянный склероз, травма спинного мозга, сосудистые мальформации, сирингомиелия, объемные образования головного и спинного мозга, эпилепсия, инфекционное поражение головного мозга (энцефалит). Среди всех нозологических форм поражения нервной системы распространенность нейропатической боли при мозговом инсульте составляет 8-10 % (Яхно Н.Н., Кукушкин М.Л., Давыдов О.С., 2008 г.).
Концепцию центральной постинсультной боли впервые выдвинул Edinger в 1891 году. Через 15 лет Дежерин и Русси в своей знаменитой работе «Таламический синдром» привели описание центральной постинсультной боли. Она характеризовалась как сильная, стойкая, приступообразная, часто нестерпимая, возникающая на стороне гемиплегии, при которой лечение обезболивающими средствами не давало эффекта. При патоморфологическом исследовании у 3 из 8 пациентов были выявлены очаги в таламусе и в заднем бугре внутренней капсулы. В 1911 году Head и Holmes подробно описали снижение чувствительности и болевые ощущения у 24 пациентов с инсультом, клинические симптомы которого свидетельствовали о поражении зрительного бугра и сопровождались центральной болью. В 1938 году Riddoch дал описание клинических проявлений боли таламического и экстраталамического происхождения.
С позиции патофизиологии центральная нейропатическая боль возникает при повреждении ЦНС с вовлечением ноцицептивных структур, что приводит к изменению ноцицептивных нейронов, а также к снижению активности антиноцицептивных нисходящих влияний. Возможным механизмом развития центральной постинсультной боли является функциональный дисбаланс между латеральными и медиальными отделами ноцицептивной системы, а также нарушение контроля корковых и таламических структур над поступающей болевой информацией. ЦПИБ может возникать при поражении соматосенсорных путей головного мозга на любом уровне, включая продолговатый мозг, таламус и кору головного мозга.
Таким образом, в патофизиологии центральной постинсультной боли играют важную роль:
1. Центральная сенситизация, являющаяся причиной хронической боли.
2. Нарушение в виде гипервозбудимости и активности в спиноталамическом тракте.
3. Очаг в латеральном таламусе, который прерывает подавляющие пути и вызывает растормаживание медиального таламуса (теория растормаживания).
4. Изменения в таламусе, поскольку он играет роль генератора боли и в нем происходит потеря тормозящих ГАМК-содержащих нейронов и активизация микроглии.
По данным MacCoulan et al., 1997 г., частота развития центральной постинсультной боли зависит от локализации мозгового инсульта. Как правило, она возникает при латеральном инфаркте продолговатого мозга (синдром Валленберга) и при поражении задневентральной части таламуса.
Таламический инфаркт характеризуется триадой симптомов: антероградной амнезией, нарушением восприятия информации и пространственными нарушениями. При инфаркте в зоне кровоснабжения парамедианных таламико-субталамических артерий наблюдается острое нарушение сознания. Возможна гиперсомния: больные пробудимы, но могут впадать в глубокий сон вскоре после прекращения стимуляции. Они испытывают апатию, безразличие, отсутствие мотивации. Выявляется глазодвигательный вертикальный парез.
При больших размерах очага инфаркта в парамедиальном таламусе присоединяется афазия, преходящая или стойкая деменция. Очаги, симметрично расположенные в парамедиальном таламусе, вызывают синдром расторможенности, включающий в себя маниакальный делирий, инфантильность или синдром Kluver — Bucy.
Для клинической картины ЦПИБ характерно ее возникновение сразу после инсульта или через несколько месяцев после него. Боль возникает в правой или левой половине тела, хотя у некоторых больных может быть локальной: в одной руке, ноге или области лица. Носит хронический, тяжелый, стойкий характер. Иногда возникает спонтанно либо обусловлена действием раздражителя. Пациенты характеризуют ее как жгучую, ноющую, леденящую, сдавливающую, пронизывающую, стреляющую, мучительную, изнуряющую. Обязательным симптомом ЦПИБ является нарушение чувствительности: температурной, болевой, реже тактильной или вибрационной, по типу гипестезии или гиперестезии. Боль значительно влияет на качество жизни пациентов, нарушает сон, ухудшает эффективность реабилитации.
Нейропатический болевой синдром характеризуется симптомокомплексом специфических чувствительных расстройств, таких как аллодиния (появление боли в ответ на неболевой стимул), гипералгезия (повышенная чувствительность к болевому стимулу), гиперестезия (повышенный ответ на тактильный стимул), гипестезия (выпадение тактильной чувствительности), гипалгезия (снижение болевой чувствительности), ощущение онемения, ползания мурашек.
Среди диагностических критериев центральной постинсультной боли выделяют обязательные и вспомогательные.
К обязательным диагностическим критериям ЦПИБ относятся:
1. Локализация боли соответственно очагу поражения в центральной нервной системе.
2. Анамнез, свидетельствующий об инсульте, и появление боли одновременно с инсультом либо позднее.
3. Подтверждение наличия патологического очага в ЦНС при визуализации либо негативные или позитивные чувствительные симптомы, которые ограничены областью, соответствующей очагу.
4. Другие причины боли, такие как ноцицептивная или периферическая нейропатическая боль, исключают либо считают маловероятными.
Вспомогательные диагностические критерии:
1. Отсутствие причинной связи с движением, воспалением или другими видами местного повреждения тканей.
2. Болевые ощущения носят жгучий, ноющий, давящий, покалывающий характер. Возможна боль, напоминающая укус насекомого, электрический разряд, болезненный холод.
3. Наличие аллодинии или дизестезии при воздействии холода или прикосновении.
В оценке клинических случаев на предмет соответствия критериям ЦПИБ используется следующая система:
1. Исключение других потенциальных причин боли. Другие явные причины боли отсутствуют.
2. Боль имеет четкую и анатомически обоснованную локализацию. Она локализуется унилатерально очагу в ЦНС на теле и/или лице либо унилатерально на теле с контралатеральным вовлечением лица.
3. Анамнез, свидетельствующий об инсульте. Неврологическая симптоматика развилась внезапно; боль появилась одновременно с инсультом либо позднее.
4. Выявление четких и анатомически обоснованных нарушений при клиническом неврологическом осмотре. При данном осмотре пациента выявляют нарушение чувствительности (с положительным или отрицательным знаком) в болезненной области. Боль локализуется в зоне чувствительных нарушений, а ее расположение может быть анатомически обосновано локализацией очага поражения в ЦНС.
5. Выявление соответствующего сосудистого очага при помощи методов нейровизуализации. При проведении КТ или МРТ визуализируют патологический очаг, который может объяснить локализацию нарушений чувствительности.
Таким образом, диагноз ЦПИБ основывается на данных анамнеза болезни, результатах клинико-неврологического обследования. Учитываются сведения о начале боли, ее характере, наличии дизестезии или аллодинии, чувствительных нарушений. Используется визуально-аналоговая шкала для оценки боли, а также данные нейровизуализации (КТ или МРТ головного мозга).
Согласно рекомендациям Европейской федерации неврологических обществ по фармакотерапии нейропатического болевого синдрома (2010 г.), в лечении ЦПИБ используют следующие группы лекарственных препаратов: антидепрессанты, антиконвульсанты (агонисты Са каналов — габапентин, прегабалин; блокаторы Na каналов — карбамазепин), опиоидные анальгетики, местные лекарственные препараты (лидокаин и др.), антагонисты NMDA-рецепторов (кетамин, мемантин, амантадин), а также нейростимуляцию.
На основании большого опыта врачей, занимающихся этой проблемой, а также данных плацебо-контролируемых исследований установлено, что наи-более эффективным подходом при лечении ЦПИБ является назначение антидепрессантов.
Механизм действия антидепрессантов заключается в блокаде обратного нейронального захвата моноаминов (серотонина, норадреналина) в ЦНС. Наибольший анальгетический эффект отмечен у амитриптилина. Выраженными анальгетическими свойствами обладают дулоксетин, венлафаксин, пароксетин. Развитие анальгетического эффекта при лечении антидепрессантами пациентов с болевыми синдромами связывают с увеличением тонической активности антиноцицептивной системы, которое происходит в результате серотонин- и норадренергического торможения ноцицептивных нейронов вследствие угнетения обратного захвата моноаминов пресинаптическими окончаниями. Это приводит к накоплению медиаторов в синаптической щели и увеличению эффективности моноаминергической синаптической передачи. Помимо собственно обезболивающего действия, антидепрессанты потенцируют влияние наркотических анальгетиков, повышая их сродство к опиоидным рецепторам.
Было проведено 17 исследований по изучению эффективности и безопасности 10 антидепрессантов в лечении нейропатического болевого синдрома. В ходе этих исследований было установлено, что нет существенной разницы в эффективности антидепрессантов с различным механизмом действия. Венлафаксин и дулоксетин, относящиеся к группе ингибиторов обратного захвата серотонина и норадреналина, продемонстрировали эффективность в лечении диабетической полинейропатии. Тразодон (Триттико) в дозировке 50-300 мг/сут показал в ряде исследований свою эффективность в лечении болевого синдрома при таких состояниях, как фибромиалгия (Molina-Barea R. еt al., 2008), диабетическая нейропатия (Wilson R.C., 1999), мигренозные боли (Brewetton T.D. et al., 1988), хроническая боль (Ventafridda V. еt al., 1988, рис. 1).
Так, в дозе до 225 мг/сутки Триттико не уступал по анальгетическому эффекту амитриптилину в лечении боли в онкологической практике. При этом прием Триттико обеспечивал тяжелым онкологическим пациентам достоверно меньшее время пребывания в стационаре, возможность вести активный образ жизни без боли и побочных эффектов, которые возникают при приеме амитриптилина (рис. 1).
Тразодон — это современная альтернатива амитриптилину в комплексном лечении пациентов с хроническим болевым синдромом.
Коллегией Всемирного конгресса по нейропсихофармакологии (Канада, Монреаль, 2002 г.) тразодон (Триттико) определен как атипичный антидепрессант с преимущественным седативным и анксиолитическим действием, первый и единственный представитель антагонистов рецепторов к серотонину 2-го типа и ингибиторов обратного захвата серотонина (SARI) в Украине. По своим фармакологическим показателям тразодон относится к группе антагонистов серотониновых рецепторов (5-НТ) и селективных ингибиторов обратного захвата серотонина (СИОЗС). Из всех свойственных ему видов лекарственного воздействия блокада серотониновых рецепторов выражена сильнее по сравнению с угнетением обратного захвата серотонина. Тразодон (Триттико) действует как антагонист на серотониновые рецепторы 2А-подтипа и как частичный агонист 5-НТ1А-рецепторов. Это обусловливает его применение при депресии, нарушении сна, при тревоге, сексуальных дисфункциях. Препарат также обладает выраженным влиянием на альфа-1-адренергические рецепторы и менее мощно ингибирует обратный захват серотонина (Stephen M., Stahl M., рис. 2).

Таким образом, тразодон благодаря уникальному комплексному мультифункциональному действию на рецепторный профиль обеспечивает мощный антидепрессивный и анксиолитический эффект в сочетании с восстановлением нарушений сна, в том числе обусловленных приемом СИОЗС.
Тразодон (Триттико) имеет мощный доказанный антидепрессивный эффект, что очень важно для постинсультных больных. По данным разных авторов, частота развития постинсультной депрессии колеблется от 25 до 79 %. Причем важно отметить, что ее развитие возможно как в ранние, так и в поздние сроки после инсульта, хотя максимальная частота депрессивных эпизодов регистрируется в восстановительном периоде ишемического инсульта.
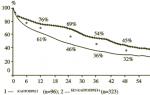
Для тразодона (Триттико) характерен выраженный противотревожный эффект, причем начиная с первых дней терапии. В двойном слепом плацебо-контролируемом рандомизированном исследовании, в котором приняли участие 230 пациентов, была показана эффективность и хорошая переносимость тразодона при генерализованном тревожном расстройстве. Пациенты были разделены на 3 группы. 1-я группа принимала имипрамин 143 мг/сут, 2-я группа — тразодон 225 мг/сут и 3-я группа — диазепам 26 мг/сут. После 8 недель терапии умеренное или существенное улучшение своего состояния отметили 73 % пациентов из группы имипрамина, 69 % — из группы тразодона, 66 % — из группы диазепама и только 47 % принимавших плацебо (рис. 3).

Исследование подтвердило, что тразодон обладает высокой эффективностью и значительно лучшей переносимостью в сравнении с другими препаратами.
Доказана эффективность Триттико в лечении больных с лобно-височной деменцией. Применение препарата в максимальной дозе 250 мг/сут (титрование дозы начинают с 50 мг) в течение 9 недель приводит к заметному улучшению симптомов: уменьшению возбуждения, раздражения, депрессии, нормализации пищевого поведения.
Для препарата Триттико характерна отличная переносимость, сопоставимая с СИОЗС, что очень важно для больных, перенесших инсульт, и обеспечивает высокую приверженность к данной терапии. Препарат не вызывает антихолинергического эффекта, ажитации, расстройства сна, сексуальной дисфункции, ортостатической гипотензии, прибавки в весе, изменений на ЭКГ, ингибирования агрегации тромбоцитов. Могут быть незначительные нарушения со стороны ЖКТ, такие как тошнота, рвота, диарея, возможна сонливость.
Дозирование Триттико производят следующим образом. В течение 1-3-го дня назначают 50 мг перед сном (1/3 табл.), что обеспечивает улучшение сна. На 4-6-й день доза составляет 100 мг перед сном (2/3 табл.), что вызывает анксиолитический эффект. С 7-го по 14-й день для антидепрессивного эффекта дозу увеличивают до 150 мг перед сном (1 табл.). И с 15-го дня для закрепления антидепресивного эффекта сохраняют дозу 150 мг либо увеличивают до 300 мг (2 табл.).
Таким образом, Триттико (тразодон) является первым и единственным представителем класса SARI в Украине, который имеет крупнейшую мировую доказательную базу и зарекомендовал себя как эффективный антидепрессант для устранения симптомов депрессии, тревоги, нарушений сна, а также в лечении пациентов с хроническим болевым синдромом.
Подготовила Татьяна Чистик
За последние несколько десятилетий проведено невероятное количество различных по своему методологическому качеству клинических исследований по оценке эффективности и безопасности антидепрессантов в терапии пациентов с различными типами болевых синдромов. Показана эффективность антидепрессантов на фоне хронических неспецифических и специфических болевых синдромах, в частности на фоне остеоартрита и ревматоидного артрита, фиброзита, фибромиалгии (Fishbain D., 2000) (Strumpf M., 2001).
Трициклический антидепрессант амитриптилин, в том числе в низких дозах, относится к числу одних из самых назначаемых антидепрессантов (Lockhart P., 2011). Orbai A.M.и Meyerhoff J.O. опубликовали обзор, в котором приводятся результаты ретроспективного анализа исходов терапии пациентов с хронической поясничной болью и люмбарным стенозом позвоночника с применением трициклических антидепрессантов в малых дозах, включая амитриптилин. Так, из 26 пациентов у 20 отмечалось улучшение картины болевого синдрома.
Причем большинство пациентов отмечали улучшения уже при приеме амитриптилина или нортриптилина в дозе 10 мг, которая оставалась на том же уровне в ходе дальнейшего лечения. Число пациентов с поясничными болями, сочетавшимися с иррадиацией в ногу, улучшение симптоматической картины, было достоверно выше в сравнении с числом пациентов только с болью в спине. Таким образом, было показано, что трициклические антидепрессанты являются эффективным терапевтическом методом контроля болевого синдрома в популяции пациентов с поясничным стенозом позвоночника (Orbai A.M., Meyerhoff J.O., 2010).
В рандомизированном, двойном слепом, плацебо-контролируемом исследовании с участием 78 мужчин с хронической поясничной болью, получавших терапию трициклическим антидепрессантом нортриптилином в дозах 50-150 нг/мл в течение 8 недель, отмечалось достоверное снижение оценок интенсивности и характера боли (Descriptor Differential Scale ) и нетрудоспособности (Impact Profile ). Достоверных различий в оценках качества жизни, связанного со здоровьем (Quality of Well-Being Scale ) настроения (Beck Depression Inventory, Spielberger State Anxiety Inventory, Hamilton Anxiety/Depression Rating Scales ) и клинических исходов болевого синдрома, оцениваемого исследователями (Clinical Global Impression) значимо не различались между группами нортриптилина и плацебо. Таким образом, было подтверждено наличие анальгетической активности нортриптилина в сравнении с плацебо, причем автономно от его антидепрессантного действия (Atkinson J.H., Slater M.A., Williams R.A., 1999).
Так, в одном психометрическом исследовании проводилась оценка потенциального влияния психологических факторов на ответ пациентов с хроническими поясничными болями, получающими лечение антидепрессантом кломипрамином. В исследовании приняли участие 30 госпитализированных пациентов с хронической болью в пояснице, получавших внутривенные инъекции антидепрессанта в течение первых 10 дней исследования и далее внутрь в таблетках в течение 20 дней.
Психологическое тестирование проводили с использованием валидированного опросника Minnesota Multiphasic Personality Inventory. Также в дни 0, 4, 10 и 30-й дни использовали тесты Saint Antoine Questionnaire , ВАШ , Schöber"s maneuver и проводили общее обследование. Так, первоначально до инициирования терапии у пациентов отмечались высокие оценки MMPI , что указывало на наличие ипохондрии, депрессии и истерии. Эти оценки достоверно снижались у 76% пациентов (n=23) к 30-му дню исследования.
Из 13 пациентов с высокими оценками по ипохондрии и истерии у 5 эти оценки значительно снижались в ходе госпитализации и возвращались к исходным значениям после возвращения домой. Таким образом, было показано, что ответ на лечение кломипрамином лучше у недепрессивных пациентов. Причем ипохондрия и истерия являются лучшими предикторами ответа на лечение антидепрессантами. Эти данные могут использоваться при отборе пациентов с хроническими спинальными болями, которые могут продемонстрировать максимальный ответ на лечение антидепрессантом (Fouquet B., 1997).
В другом клиническом исследовании проводилось сравнение эффектов доксепина и дезипрамина в дозах 188 мг/день и 173 мг/день соответственно в терапии 36 добровольцев с хроническими спинальными болями и аффективными или дистимическими расстройствами. Терапия обоими антидепрессантами ассоциировалась с достоверным редуцированием симптомов депрессии (70%). Интенсивность боли также снижалась в обеих группах (ответ у 50% пациентов). При этом тяжесть боли снижалась более интенсивно в группе доксепина. Уровень β-эндорфина в спинномозговой жидкости не изменялся на фоне лечения (Ward N., 1984). В другом рандомизированном исследовании доксепин продемонстрировал способность индуцировать нежелательные явления со стороны автономной нервной система (антихолинергические эффекты) и седацию (Amsterdam J.D., 1982).
Hameroff S.R. и соавт. опубликовали результаты 6-недельного, рандомизированного, двойного слепого клинического исследования по оценке эффективности доксепина в терапии хронической боли в спине и шее, проводившегося с участием 36 пациентов. Так, терапия антидепрессантом приводила к достоверному улучшению симптоматической картины депрессии (Hamilton depression scores ), тяжести боли (Global Assessment Scale scores) , снижению негативного влияния боли на активность пациентов, улучшению сна и мышечного напряжения. Некоторые из этих положительных изменений отмечались уже через 1 неделю после начала приема. Доза доксепина в исследовании составляла 200 мг/день, а концентрация доксепина и его метаболита нор-доксепина в плазме крови добровольцев в среднем составляла 80 нг/мл.
Терапия доксепином не ассоциировалась с нежелательными явлениями. Достоверных изменений концентраций β-эндорфина и/или энкефалина в спинномозговой жидкости не отмечалось (Hameroff S.R., 1984). Таким образом, доксепин может рассматриваться в качестве потенциального адъювантного анальгетика в терапии пациентов с хронической болью на фоне депрессии (Aronoff G.M., Evans W.O., 1982).
Воробьева О.В. и Акарачкова Е.С. представили результаты клинического наблюдения 20 пациентов с хронической дорсалгией, получавших антидепрессант тианептин (Коаксил®) в дозе 12,5 мг 3 раза в день. Согласно результатам психометрического тестирования у 90% пациентов отмечались признаки депрессии. Терапия тианептином в течение 6 недель ассоциировалась с редуцированием картины депрессии, ослаблением мышечной дисфункции и болевого синдрома. Также отмечалась положительная динамика автономной дисфункции, нарушений сна и качества жизни. Таким образом, авторы отметили, что тианептин является высокоэффективным и безопасным методом терапии депрессии на фоне хронических болей в спине и оказывает позитивное влияние на болевой синдром (Воробева О.В., Акарачкова Е.С., 2004).
В одном открытом, сравнительном исследовании, проводившемся в России, проведена оценка эффективности и переносимости препарата венлафаксина пролонгированного действия (Велаксин) в дозе 75 мг/день в течение 8 недель в терапии 48 пациентов с подострыми или хроническими болями на фоне спондилогенной дорсопатии. Интенсивность анальгетического действия антидепрессанта оценивали на основании средних оценок по шкалам ВАШ и VPS 34 , ограничения ежедневной активности по опроснику Modified Pain Disability Questionnaire (mPDQ) , а также измеряли оценки тревожности и депрессии.
Для лечения болевых синдромов нашли применение антидепрессанты, к которым прежде всего относится трициклический антидепрессант амитриптилин. К сожалению, его применение при болевых синдромах ограничено из-за побочных эффектов. В связи с этим внимание специалистов привлекли к себе препараты новых поколоний, в частности венлафаксин, который отличается более благоприятным профилем безопасности. В настоящем обзоре обобщены клинические и патофизиологические данные, касающиеся применения этого препарата при различных болевых синдромах.
Применение антидепрессантов при хронической боли
Большое депрессивное расстройство и генерализованное тревожное расстройство часто сопровождаются хроническими болевыми синдромами. Примерами таких синдромов могут быть боль в спине, головная боль, боль в желудочно-кишечном тракте и боль в суставах. Кроме того, большие трудности лечения представляют и ряд болевых синдромов, не связанных с депрессивными и тревожными расстройствами (диабетическая и постгерпетическая невралгия, раковая боль, фибромиалгия).
Связь между большим депрессивным расстройством и генерализованным тревожным расстройством с болевыми и не болевыми соматическими симптомами была отмечена клиницистами уже давно . В одном международном исследовании было показано, что при первичном осмотре 69% пациентов с глубоким депрессивным расстройством имели только соматические жалобы и у них не было ни одного психопатологического симптома . В другом исследовании было продемонстрировано, что увеличение количества физических симптомов увеличивает вероятность наличия у пациента депрессивного или тревожного расстройства .
Помимо большого депрессивного и генерализованного тревожного расстройства, боль является одной из основных жалоб при фибромиалгии, синдроме раздраженной кишки, хронической тазовой боли, мигрени, вульводинии, интерстициальном цистите, симптоме височно-нижнечелюстного сустава. Некоторые исследователи предполагают, что такие нарушения аффективного спектра, как большое депрессивное расстройство, генерализованное тревожное расстройство, социальные фобии, фибромиалгия, синдром раздраженной кишки и мигрень могут иметь общую генетическую предрасположенность.
Точная причинно-следственная связь между хронической болью и депрессией остается неизвестной, но выдвигаются следующие гипотезы: депрессия предшествует развитию хронической боли; депрессия является результатом хронической боли; эпизоды депрессии, встречающиеся перед началом хронической боли, предрасполагают к развитию депрессивных эпизодов после начала хронической боли; психологические факторы, такие как дезадаптивные копинг-стратегии, способствуют формированию взаимодействия между депрессией и хронической болью; депрессия и боль имеют сходные характеристики, но представляют собой различные нарушения .
Многочисленные исследования показали, что антидепрессанты двойного действия (селективные ингибиторы обратного захвата серотонина — СИОЗС, и норадреналина), используемые для лечения депрессии, также могут быть эффективны при лечении хронической боли . Препараты двойного действия, такие как трициклические антидепрессанты (амитриптилин, кломипрамин) и венлафаксин, или комбинация антидепрессантов с серотонинергическим и норадренергическим эффектом, продемонстрировали бoльшую эффективность лечения по сравнению с антидепрессантами, действующими преимущественно на одну нейромедиаторную систему .
Так, флуоксетин (за счет преимущественного увеличения серотонина) и дезипрамин (за счет преимущественного увеличения норадреналина) вызывают более быстрый и лучший терапевтический эффект, чем монотерапия дезипрамином . В другом исследовании было показано, что кломипрамин (антидепрессант двойного действия) вызывает ремиссию депрессии в 57—60% случаев по сравнению с группой пациентов, которые принимали моноаминоергические антидепрессанты — циталопрам или пароксетин (ремиссия всего у 22—28% пациентов). Мета-анализ 25 двойных слепых исследований выявил более высокую эффективность антидепрессантов двойного действия (кломипрамин и амитриптилин) по сравнению с трициклическими антидепрессантами моноаминергического действия (имипрамин, дезипрамин) и селективными ингибиторами серотонина (флуоксетин, флувоксамин, пароксетин, циталопрам) .
Анализ 8 клинических исследований по изучению эффективности венлафаксина по сравнению с селективными ингибиторами серотонина (пароксетин, флуоксетин, флувоксамин) обнаружил, что частота ремиссии после 8-недельного приема препаратов была значительно выше в группе пациентов, получавших венлафаксин (45%) по сравнению с теми, кто получал селективные ингибиторы обратного захвата серотонина (35%) или плацебо (25%) .
Двойное воздействие на серотонин и норадреналин обусловливает более выраженный эффект и при лечении хронической боли . Как серотонин, так и норадреналин вовлекаются в контроль боли через нисходящие пути болевой чувствительности . Это объясняет, почему большинство исследователей обнаруживают преимущество антидепрессантов с двойным действием для лечения хронической боли. Точный механизм действия, путем которого антидепрессанты вызывают аналгетический эффект, остается неизвестным. Тем не менее антидепрессанты с двойным механизмом действия обладают более длительным обезболивающим эффектом, чем антидепрессанты, которые воздействуют только на одну из аминергических систем.
Лечение венлафаксином
Применение трициклических антидепрессантов при болевых синдромах ограничено из-за многочисленных побочных эффектов, таких как седация, когнитивные нарушения, ортостатическая гипотензия, нарушения сердечного ритма, сухость во рту, запоры, что связано со сродством трициклических антидепрессантов к мускариновым, холинергическим, гистаминовым и a1-адренорецепторам.
Препарат венлафаксин, как и трициклические антидепрессанты, ингибирует обратный захват серотонина и норадреналина, но отличается более благоприятным профилем безопасности, так как не имеет сродства к мускариновым, холинергическим, гистаминовым и a1-адренорецепторам. Венлафаксин продемонстрировал свою эффективность и безопасность на нескольких моделях животных , здоровых добровольцах и пациентах с разными болевыми синдромами.
В исследовании E. Lang и соавт. применение венлафаксина привело к снижению проявлений гипералгезии, вызванной хирургической компрессией седалищного нерва. Эффект был обнаружен как при профилактическом приеме венлафаксина (перед операцией), так и при применении венлафаксина после операции, т.е. после развития нейропатического повреждения . В другом исследовании однократная доза венлафаксина не оказывала эффекта на здоровых крыс, тогда как на моделях с хронической компрессией седалищного нерва было отмечено повышение болевого порога. В исследованиях с многократным приемом венлафаксина была продемонстрирована эффективность в группе здоровых крыс и крыс с хронической компрессией седалищного нерва. Эти эффекты подавлялись a-метил-p-тирозином (ингибитор синтеза норадреналина) и парахлорфенилаланином (ингибитор синтеза серотонина), но не налоксоном (опиоидный антагонист), что указывает на особый механизм действия венлафаксина, не связанный с опиодными нейротрансмиттерными системами.
В исследовании на крысах с винкристин-индуцированной нейропатией оценивали интегративный супраспинальный болевой ответ — вокализацию в ответ на надавливание лапы, и спинальный С-волоконный ноцицептивный вызванный рефлекс . Результаты показали, что венлафаксин индуцирует дозозависимое повышение порога вокализации при тесте надавливания на лапу и умеренное, но дозозависимое подавление С-волоконного вызванного рефлекса. Следовательно, оба супраспинальный и спинальный механизмы могут быть вовлечены при антигипералгетическом эффекте венлафаксина. На моделях крыс с односторонней мононевропатией показано, что венлафаксин в комбинации с трамадолом увеличивает болевой порог по сравнению с применением только венлафаксина или только трамадола, или плацебо. Эти факты могут указывать на то, что венлафаксин может усиливать антиноцицептивные эффекты опиоидов.
На другой модели изучения эффектов венлафаксина был продемонстрирован дозозависимый антиноцицептивный эффект у мышей после интраперитонеального введения препарата. Косвенный рецепторный анализ показал, что венлафаксин воздействовал на k-опиоидные и o-опиоидные субтипы рецепторов, а также на a2-адренергические рецепторы. Данное исследование указывает на возможное вовлечение опиоидных систем при применении венлафаксина.
Аналгетический эффект венлафаксина у людей изучен в группе из 16 здоровых добровольцев в рандомизированном двойном слепом перекрестном исследовании . У испытуемых, получавших венлафаксин, отмечалось достоверное повышение болевых порогов после одиночной электрической стимуляции. При холодовой пробе и тесте с болевым прессором не было получено достоверных изменений болевых порогов.
Также были проведены многочисленные исследования эффективности венлафаксина у пациентов с хроническими болевыми синдромами. Кроме того, было проведено открытое исследование, длившееся 1 год, по изучению эффективности и безопасности венлафаксина у 197 пациентов с диагностированным большим депрессивным расстройством с болевым синдромом или без него . Лечение трициклическими антидепрессантами, также как и СИОЗС у этих пациентов оказалось безуспешным. Тяжесть депрессии оценивалась по шкале Гамильтона, а интенсивность боли — по визуальной аналоговой шкале (ВАШ). Пациенты принимали пролонгированную форму препарата — венлафаксин-ХR. Доза венлафаксина-XR титровалась каждые 3 дня, средняя доза составила 225 мг 1 раз в день. Использование дополнительных антидепрессантов и опиат-опиоидных аналгетиков не разрешалось, тем не менее, разрешалось применение ингибиторов циклооксигеназы-2 для кратковременного облегчения боли. У пациентов в группе «депрессия+боль» наблюдались следующие виды боли: боль в спине, постоперационная боль в бедре, остеоартрит, фибромиалгия, комплексный регионарный болевой синдром, региональная миофасциальная боль, карпальный туннельный синдром, мигрень и боль, связанная с полиневропатией. После применения венлафаксина отмечалось достоверное снижение количества баллов по шкале депрессии Гамильтона как у пациентов с депрессией, так и в группе пациентов «депрессия+боль». Помимо этого, у пациентов в группе «депрессия+боль» было отмечено достоверное снижение уровня боли по ВАШ. 11 пациентов были исключены из исследования по причине побочных эффектов, таких как тошнота, тревога, ажитация, сексуальные расстройства.
Ретроспективный анализ 5 двойных слепых с применением плацебо рандомизированных исследований для оценки влияния венлафаксина на различные симптомы, в том числе и на боль был проведен у пациентов с генерализованным тревожным расстройством без депрессии . Применение венлафаксина пролонгированного действия привело к достоверно большему снижению болевых проявлений у пациентов с генерализованным тревожным расстройством через 8 нед и через 6 мес лечения по сравнению с плацебо.
Нейропатическая боль связана с повреждением собственно нервной системы на центральном (постинсультная, фантомная боль, тригеминальная невралгия) и периферическом уровне (диабетическая полиневропатия, постгерпетическая невралгия). В отличие от ноцицептивной, нейропатическая боль плохо поддается лечению аналгетиками (в том числе опиоидными) и нестероидными противовоспалительными препаратами (НПВП). Препаратами первой линии для большинства нейропатических болевых синдромов являются трициклические антидепрессанты (за исключением тригеминальной невралгии, при которой препаратом первого ряда является карбамазепин). К сожалению, частые побочные эффекты ограничивают широкое применение трициклических антидепрессантов.
Эффективность венлафаксина исследовалась при болевой форме диабетической невропатии , полиневропатии и нейропатической боли вследствие рака молочной железы .
В исследование венлафаксина при болевой диабетической невропатии было рандомизировано 244 пациента без депрессии, которые получали венлафаксин-XR в дозе 75 мг/сут (81 пациент), 150-225 мг/сут (82 пациента) или плацебо (81 пациент) сроком до 6 нед . Пациенты, включенные в исследование, испытывали ежедневную боль умеренной или выраженной интенсивности (по ВАШ) по крайней мере на протяжении 3 мес, предшествовавших исследованию. Пациенты, получавшие венлафаксин-XR в дозе 150-225 мг/сут, продемонстрировали достоверно более выраженное снижение интенсивности боли к 3—6-й нед лечения по сравнению с плацебо и к 5—6-й нед лечения по сравнению с пациентами, получавшими 75 мг/сут. Наиболее выраженное улучшение отмечалось на 6-й нед лечения. Этот факт указывает на то, что для адекватной оценки аналгетической эффективности венлафаксина необходим 6-недельный курс лечения.
Наиболее частым побочным эффектом в этом исследовании была тошнота, которая проявлялась у 5% пациентов в группе, принимавшей плацебо, у 22% — в группе пациентов, принимавших 75 мг венлафаксина, и у 10% пациентов, принимавших 150-225 мг венлафаксина. Выход из исследования из-за побочных эффектов составил 4, 7 и 10% соответственно в группе плацебо, принимавших 75 мг и 150—250 мг венлафаксина.
Рандомизированное, контролируемое, двойное-слепое, тройное-перекрестное исследование оценивало эффективность венлафаксина, имипрамина и плацебо у пациентов с болезненной формой полиневропатии, длящейся не менее 6 мес . Доза венлафаксина титровалась до 112,5 мг 2 раза в сут, имипрамина до 75 мг 2 раза в сутки. Оценка эффективности проводилась через 4 нед лечения. Пациенты, которые получали венлафаксин, продемонстрировали достоверное улучшение по сравнению с плацебо (р<0,001), достоверных различий в эффективности между группами венлафаксина и имипрамина не было. Частота таких побочных явлений, как сухость во рту и повышенная потливость встречались чаще в группе имипрамина, а усталость чаще встречалась в группе венлафаксина.
В 10-недельном рандомизированном двойном слепом плацебо-контролируемом перекрестном исследовании у пациентов с нейропатической болью после лечения рака молочной железы, применяли венлафаксин в дозе 75 мг/сут . Было отмечено существенное снижение интенсивности боли в группе венлафаксина по сравнению с плацебо по вербальной оценочной шкале.
Ряд открытых исследований и описанных случаев применения венлафаксина указывают на эффективность этого препарата при различных видах боли . Участие в проспективном, плацебо-контролируемом, двойном слепом исследовании приняли 150 пациентов с мигренью с аурой и без ауры (длительность заболевания от 1 до 4 лет). Сравнивалась эффективность венлафаксина, флуоксетина, сертралина и пароксетина при профилактическом лечении мигрени . Лечение продолжалось 3 мес и более. Значительное число пациентов, принимавших венлафаксин, отметили улучшение в своем состоянии по сравнению с плацебо и другими препаратами. Досрочно прекратили лечение из-за неспецифических побочных эффектов 2 пациента из группы венлафаксина.
В одном из центров головной боли был проведен ретроспективный анализ данных 97 пациентов с хронической головной болью (хроническая головная боль напряжения, мигрень с аурой и без ауры, сочетание мигрени и головной боли напряжения) со сроком заболевания не менее 2 лет, получавших лечение венлафаксином в дозе 75 мг 2 раза в день. Отметили снижение количества приступов 37% включенных в анализ пациентов, 45% не обнаружили никаких изменений, а у 18% пациентов увеличилось число приступов головных болей.
Ретроспективное открытое исследование по изучению влияния венлафаксина-XR при лечении мигрени и хронической головной боли напряжения показало достоверное снижение числа приступов головных болей в месяц при последнем визите по сравнению с началом лечения в обеих группах. В группе мигрени среднее количество приступов головной боли в месяц снизилось с 16,1 до 11,1. В группе головной боли напряжения среднее количество эпизодов головной боли снизилось с 24 до 15,2 .
Н.В. Латышева и Е.Г. Филатова исследовали влияние венлафаксина («Плива», велафакс) при хронической ежедневной головной боли. В исследовании приняли участие 69 пациентов с хронической ежедневной головной болью и 30 пациентов с эпизодической мигренью, а также 15 участников группы контроля. В ходе исследования было показано, что венлафаксин является эффективным и безопасным средством для урежения приступов головной боли. Профилактическое лечение велафаксом приводит к выраженному клиническому облегчению состояния пациентов, сокращению приема аналгетиков. По мнению авторов, позитивный эффект препарата может быть связан с уменьшением выраженности аллодинии, что было подтверждено нормализацией порога болевого R3-компонента мигательного рефлекса, который отражает функциональное состояние стволовых структур и спинномозгового ядра тройничного нерва, участвующих в поддержании центральной сенситизации.
Венлафаксин эффективен также в лечении фибромиалгии. В исследовании M. Dwight и соавт. у 60% пациентов с диагнозом фибромиалгия были обнаружены сопутствующие большое депрессивное и генерализованное тревожное расстройства. Средняя доза венлафаксина составляла 167 мг/сут (варьировала от 37,5 до 300 мг/сут). Результаты оценивались по шкале тревоги и депрессии Гамильтона, с помощью болевого опросника Мак Гилла и ВАШ. В результате лечения было отмечено достоверное улучшение по изучаемым показателям эффективности. Наиболее часто встречающимися побочными эффектами оказались запоры, сухость во рту, слабость, инсомния и тошнота.
Операции по поводу рака груди часто приводят к развитию постоперационной нейропатической боли. Было проведено рандомизированное двойное слепое исследование, в котором приняли участие 80 женщин, подвергнутых частичной или тотальной мастэктомии по поводу рака груди. Авторы оценивали влияние венлафаксина на постмастэктомический болевой синдром . Лечениe начиналось за ночь до операции и продолжалось на протяжении 2 нед после операции. Пациенты получали венлафаксин в дозе 75 мг/сут или плацебо. Назначение венлафаксина достоверно снизило частоту постмастэктомической боли в грудной клетке (28,7 vs 8,7%; р=0,002), в подмышечной области (26,5 vs 10%; p=0,01) и в руке (22,5% vs 8,7%; p=0,002) по сравнению с плацебо. Не было достоверных различий в отношении постоперационной аналгезии, отека, фантомной боли или сенсорных изменений.
Заключение
Ноцицептивная передача импульса предполагает вовлечение восходящих афферентных соматосенсорных, спиноталамических путей, которые проходят через пластину заднего дорсального рога спинного мозга. Эти ноцицептивные импульсы модулируются через активацию нисходящих тормозных путей, происходящих из околоводопроводного серого вещества мозга. И серотонин, и норадреналин вовлекаются в нисходящие тормозные механизмы и способствуют изменениям нейрохимической передачи в спинном мозге. Эти изменения могут облегчать освобождение субстанции Р, нейротрансмиттера, усиливающего ноцицептивную передачу, а также влиять на эффекты эндогенных эндорфинов. Результаты вышеприведенных исследований поддерживают предположение о том, что аналгетический эффект антидепрессантов является результатом внутренних аналгетических свойств молекул антидепрессантов, а не косвенного влияния антидепрессантов на боль через уменьшение депрессии или общий седативный эффект .
Венлафаксин является ингибитором обратного захвата серотонина и норадреналина . Посредством их механизмов обеспечивается купирование нейропатической боли. Венлафаксин не связывается с мускарин-холинергическими, гистаминовыми и a1-адренергическими рецепторами, благодаря чему при его назначении удается избежать многих нежелательных явлений, развивающихся при применении трициклических антидепрессантов.
Клинические исследования указывают на то, что применение венлафаксина является хорошим методом лечения для пациентов с хроническими болевыми синдромами в рамках большого депрессивного или генерализованного тревожного расстройства. Это важно, поскольку более чем у 40% пациентов с большим депрессивным расстройством имеются хотя бы один болевой симптом (головная боль, боль в спине, боль в суставах, боль в конечностях или боль в желудочно-кишечном тракте) . Применение венлафаксина позволяет снизить и уровень депрессии, и выраженность болевых проявлений.
Венлафаксин-XR назначается при большом депрессивном, генерализованном тревожном и социальном тревожном расстройствах в дозах от 75 до 225 мг/сут . Для некоторых пациентов эффективными могут быть низкие дозы венлафаксина. Лечение можно начинать с 37,5 мг/сут с постепенным увеличением дозы в течение 4-7 дней до 75 мг/сут.
Проведенные исследования показали, что аналгетический эффект венлафаксина обусловлен механизмами, не связанными с депрессией. В связи с этим венлафаксин оказался эффективным и при болевых синдромах, не связанных с депрессией и тревогой. Хотя показания назначения венлафаксина при хронической боли еще не включены в инструкцию по его применению, имеющиеся данные указывают на то, что при большинстве болевых синдромов эффективной является доза 75-225 мг/сут. Данные рандомизированных, контролируемых исследований показали, что облегчение боли наступает через 1-2 нед после начала лечения. Тем не менее некоторым пациентам требуется 6-недельный курс лечения для того чтобы аналгетический эффект венлафаксина стал очевидным.
Самым частым побочных эффектом венлафаксина, обнаруженном при лечении боли, является тошнота. Другими побочными эффектами являются ажитация, анорексия, запоры, головокружение, сухость во рту, головная боль, инсомния, сонливость, сексуальные расстройства, рвота.
В настоящее время показание венлафаксина для «лечения хронической боли» еще не зарегистрировано. Необходимы дальнейшие исследования для уточнения эффективности, способов дозирования и безопасности венлафаксина при различных болевых синдромах.
Литература
- Латышева Н.В., Филатова Е.Г. Новый механизм хронизации головной боли: патогенетическая гипотеза и ее значение для терапии. Лечащий врач 2008; 5: 82-84.
- Adelman L.C., Adelman J.U., Von Seggern R., Mannix L.K. Venlafaxine extended release (XR) for the prophylaxis of migraine and tension-type headache: a retrospective study in a clinical setting. Headache 2000; 40: 572-580.
- Anderson I.M. SSRIs versus tricyclic antidepressants in depressed inpatients: a meta-analysis of efficacy and tolerability. Depress Anxiety 1998; 7: 11-17.
- Ansari A. The efficacy of newer antidepressants in the treatment of chronic pain: a review of current literature. Harvard Rev Psychiat 2000; 7: 257-277.
- Barkin R.L., Fawcett J. The management challenges of chronic pain: the role of antidepressants. Am J Ther 2000; 7: 31-47.
- Bradley R.H., Barkin R.L., Jerome J. et al. Efficacy of venlafaxine for the long-term treatment of chronic pain with associated major depressive disorder. Am J Ther 2003 10: 318-323.
- Davis J.L., Smith R.L. Painful peripheral diabetic neuropathy treated with venlafaxine HCl extended release capsules . Diabetes Care 1999; 22: 1909-1910.
- Diamond S. Efficacy and safety profile of venlafaxine in chronic headache. Headache Q Curr Treat Res 1995; 6: 212-214.
- Dwight M.M., Arnold L.M., O’Brien H. et al. An open clinical trial of venlafaxine treatment of fibromyalgia. Psychosomatics 1998; 39: 14-17.
- Enggaard T.P., Klitgaard N.A., Gram L.F. et al. Specific effect of venlafaxine on single and repetitive experimental painful stimuli in humans. Clin Pharmacol Ther 2001; 69: 245-251.
- Erdemoglu A.K. Effectiveness of venlafaxine in symptomatic treatment of diabetic neuropathy . Ann Neurol 2002; 52: S64.
- Kathpal G.S. Role of SSRIs in the management of migraine. Headache Q Curr Treat Res 1998; 9: 265-266.
- Kiayias J.A., Vlachou E.D., Lakka-Papadodima E. Venlafaxine HCl in the treatment of painful peripheral diabetic neuropathy . Diabetes Care 2000; 23: 699.
- Kirmayer L.J., Robbins J.M., Dworkind M., Yaffe M.J. Somatization and the recognition of depression and anxiety in primary care. Am J Psychiat 1993; 150: 734-741.
- Krishnan K.R., France R.D., Pelton S. et al. Chronic pain and depression. II. Symptoms of anxiety in chronic low back pain patients and their relationship to subtypes of depression. Pain 1985; 22: 289-294.
- Krishnan K.R., France R.D., Pelton S. et al. Chronic pain and depression. I. Classification of depression in chronic low back pain patients. Pain 1985; 22: 279-287.
- Kroenke K., Price R.K. Symptoms in the community. Prevalence, classification, and psychiatric comorbidity. Arch Intern Med 1993; 153: 2474-2480.
- Kunz N., Goli V., Entsuah R. et al. Diabetic neuropathic pain management with venlafaxine extended release. Eur Neuropsychopharmaco 2000; 10: 389-389.
- Lang E., Hord A.H., Denson D. Venlafaxine hydrochloride (Effexor) relieves thermal hyperalgesia in rats with an experimental mononeuropathy. Pain 1996; 68: 151-155.
- Lithner F. Venlafaxine in treatment of severe painful peripheral diabetic neuropathy. Diabetes Care 2000; 23: 1710-1711.
- Lynch M.E. Antidepressants as analgesics: a review of randomized controlled trials. J Psychiat Neurosci 2001; 26: 30-36.
- Magni G. The use of antidepressants in the treatment of chronic pain: a review of the current evidence. Drugs 1991; 42: 730-748.
- Marchand F., Alloui A., Chapuy E. et al. Evidence for a monoamine-mediated, opioid-independent, antihyperalgesic effect of venlafaxine, a nontricyclic antidepressant, in a neurogenic pain model in rats. Pain 2003; 103: 229-235.
- Marchand F., Alloui A., Pelissier T. et al. Evidence for an antihyperalgesic effect of venlafaxine in vincristine-induced neuropathy in rat. Brain Res 2003; 980: 117-120.
- Max M.B., Lynch S.A., Muir J. et al. Effects of desipramine, amitriptyline, and fluoxetine on pain in diabetic neuropathy. N Engl J Med 1992; 326: 1250-1256.
- Meoni P. Pattern of symptom improvement following treatment with venlafaxine XR in patients with generalized anxiety disorder. J Clin Psychiat 2001; 62: 888-893.
- Muth E.A., Haskins J.T., Moyer J.A. et al. Antidepressant biochemical profile of the novel treatment of pain syndromes with venlafaxine. Biochem Pharmacol 1986; 35: 4493-4497.
- Muth E.A., Moyer J.A., Haskins J.T. et al. Biochemical, neurophysiological, and behavioral effects of Wy- 45,233 and other identified metabolites of the antidepressant venlafaxine. Drug Dev Res 1991; 23: 191-199.
- Nascimento E.D. Prophylaxis of migraine: open study with venlafaxine in 42 patients. Arquivos de Neuro-Psiquiatria 1998; 56: 744-746.
- Nelson J.C., Mazure C.M., Bowers M.B., Jatlow P.I. A preliminary open study of the combination of fluoxetine and desipramine for rapid treatment of major depression . Arch Gen Psychiat 1991; 48: 303-307.
- Ohayon M., Schatzberg A. Using chronic pain to predict depressive morbidity in the general population. Arch Gen Psychiat 2003; 60: 39-47.
- Onghena P., Van Houdenhove B. Antidepressant-induced analgesia in chronic nonmalignant pain: a meta-analysis of 39 placebo-controlled studies . Pain 1992; 49: 205-219.
- Pernia A., Mico J.A., Calderon E., Torres L.M. Venlafaxine for the treatment of neuropathic pain. J Pain Symptom Manage 2000; 19: 408-410.
- Reuben S., Lurie S., Deluca P., Charles G.S. Efficacy of the perioperative administration of venlafaxine XR in the prevention of postmastectomy pain syndrome. Presented at the 27th meeting of the American Society of Regional Anesthesia and Pain Medicine, Chicago, IL 2002.
- Rudolph R.L., Feiger A.D. A double-blind, randomized, placebo controlled trial of once-daily venlafaxine extended release (XR) and fluoxetine for the treatment of depression. J Affective Disord 1999; 56: 171-181.
- Schreiber S., Backer M.M., Pick C.G. The antinociceptive effect of venlafaxine in mice is mediated through opioid and adrenergic mechanisms. Neurosci Lett 1999; 273: 85-88.
- Simon G.E., VonKorff M., Piccinelli M. et al. An international study of the relation between somatic symptoms and depression . N Engl J Med 1999; 341: 1329-1335.
- Sindrup S.H., Bach F.W., Madsen C. et al. Venlafaxine versus imipramine in painful polyneuropathy: a randomized, controlled trial. Neurology 2003; 60: 1284-1289.
- Smith D., Dempster C., Glanville J. et al. Efficacy and tolerability of venlafaxine compared with selective serotonin reuptake inhibitors and other antidepressants: a meta-analysis. Br J Psychiat 2002; 180: 396-404.
- Songer D.A., Schulte H. Venlafaxine for the treatment of chronic pain . Am J Psychiat 1996; 153: 737.
- Sumpton J.E., Moulin D.E. Treatment of neuropathic pain with venlafaxine. Ann Pharmacother 2001; 35: 557-559.
- Tasmuth T., Haertel B., Kalso E. Venlafaxine in neuropathic pain following treatment of breast cancer. Eur J Pain London 2002; 6: 17-24.
- Taylor K., Rowbotham M.C. Venlafaxine hydrochloride and chronic pain. Western J Med 1996; 165: 147-148.
- Thase M.E., Entsuah A.R., Rudolph R.L. Remission rates during treatment with venlafaxine or selective serotonin reuptake inhibitors. Br J Psychiat 2001; 178: 234-241.
- Uyar M., Onal A., Dogru A., Soykan N. The antinociceptive effect of tramadol-venlafaxine combination on the paw withdrawal threshold in a rat model of neuropathic pain. Methods Find Exp Clin Pharmacol 2003; 25: 361-365.
- Vestergaard P., Gram L.F., Kragh-Sorensen P. et al. Therapeutic potentials of recently introduced antidepressants: Danish university antidepressant group. Psychopharmacol Ser 1993; 10: 190-198.
- Willis W.D., Westlund K.N. Neuroanatomy of the pain system and of the pathways that modulate pain. J Clin Neurophysiol 1997; 14: 2-31.
- Wyeth Pharmaceuticals. Effexor XR (venlafaxine) package insert Philadelphia, PA, 2003.
Статьи
ВрачЯ. Левин, Е. Демина, Л. Добровольская, А. Остроумова
П.Р. Камчатнов
Русский медицинский журнал
Камчатнов П.Р., Радыш Б.Б., Кутенев А.В., Казаков А.Ю.
Русский медицинский журнал
Мосолов С.Н.
Русский медицинский журнал
I. Острая, хроническая ипатологическая боль. Патофизиологические и клинические особенности хроническойболи. Основные виды хронических болевых синдромов. Нейрохимия хронической боли.
Острая боль
-симптом какой-либо внезапно возникшей
патологии или повреждения тканей. Острыйболевой синдром можно назвать физиологическим, поскольку он выполняетопределённую защитную функцию и, сигнализируя о развитии патологическихпроцессов в тканях, способствует развитию в организме адаптационных комплексныхреакций. Терапия острой боли обычно направлена на устранение причины, провоцирующейэту боль, либо на уменьшение её алгогенного действия (блокады).
Хроническая или рецидивирующаяболь
имеет многокомпонентное происхождение, в основе которого лежат нетолько патофизиологические, но и тесно взаимодействующие психологические исоциальные факторы. Хроническая боль также носит название патологической боли, вследствиетого, что она имеет
патогенное значение для организма, и, вызывая расстройствофункций ЦНС, психические и эмоциональные нарушения, ведёт к повреждениювнутренних органов.
Хроническая (патологическая) боль -самостоятельное заболевание с первичным патологическим процессом в соматическойсфере и вторичной дисфункцией периферической и центральной нервной системе.
Главныеотличия хронической (патологической) боли :
u длительность(не менее 3 - 6 мес.),
u повышениеустойчивости пациента к проводимой терапии,
u отсутствиепрямой зависимости от выявления и устранении вызвавшей её причины.
Типыхронической боли:
1) Боль в результате непрекращающегося длительного воздействия(грыжа межпозвонкового диска).
2) Боль после остройтравмы, но продолжающаяся значительно дольше нормального периода заживления(каузалгия, регионарный болевой синдром, фантомная боль).
3) Больбез определённой, видимой, заметной причины (головные боли мышечногонапряжения, мигрень).
§ Хроническая боль – это самостоятельное заболевание, в патогенезе котороговедущее значение имеют психо-эмоциональные и социальные факторы. При данномтипе боли может отсутствовать прямая связь между болью и вызвавшей её причиной.
§В механизмах развитияхронической боли и депрессии лежат общие медиаторные системы.
§Согласноэпидемиологическим исследованиям существует тесная связь между депрессией ихронической болью.
Известны различные классификациихронической боли.
В основебольшинства из них лежит локализация болевого синдрома :
o головные боли,
o боли в шее и спине,
o лицевые боли,
o боли в конечностях,
o боли в груди,
o боли в животе,
o боли в области таза.
Различают также боли соматического происхождения, нейрогенные и психогенные боли .В механизмахразвития хронической боли, независимо от её локализации и происхождения, важноезначение отводится медиаторным системам головного и спинного мозга:
v Серотонинергической
v Норадренергической
v Дофаминергической
v ГАМК-ергической
v Пептидергической (опиоидно и неопиоидной).
В ходемножества клинических и экспериментальных исследований установлено:
- Интратекальное введение серотонина вызывает анальгезию и угнетает активность нейронов дорзальных рогов спинного мозга, вызванных болевой стимуляцией.
- При введении в определённые зоны головного мозга (большое ядро шва) ингибиторов обратного захвата серотонина, что способствует высвобождению серотонина из синаптических терминалей, развивается анальгетический эффект.
- Избирательное разрушение нисходящих серотонинергических путей усиливает болевую реакцию.
При исследовании влияния адренергическоймедиаторной системы получены подобные результаты. Выяснено, что норадреналинмодулирует болевые сигналы, как на супрасегментарном, так и на спинальномуровнях. Вследствие чего, блокаторы адренергических рецепторов повышают болевуючувствительность, а агонисты (клофелин) тормозят активность ноцицептивныхнейронов в ответ на болевое раздражение.
II. Хроническая боль идепрессия.
По результатам многочисленных клинико -эпидемиологических исследований установилено, что существует тесная связь междухронической болью и депрессией. Распространению депрессии среди пациентов схронической болью колеблются от 30 до 87%. По мнению некоторых исследователей,депрессия - ведущий фактор в снижении трудоспособности у больных с хроническойболью, либо наиболее значимой мотивацией при обращении за медицинской помощью.Связь депрессивных расстройств и хронической боли не представляетсяоднозначной, и существsуют различные альтернативные варианты ихпричинно-следственных отношений:
1) Хроническая боль -причина депрессии.
2) Пациенты сдепрессией более склонны к восприятию болей.
3) Хроническая боль идепрессия опосредованно связаны другими промежуточными факторами (потерядееспособности).
III. Фармакотерапияхронической боли. Адъювантная терапия. Использование антидепрессантов в лечениихронической боли.
Основные группы препаратов используемыев медикаментозной терапии хронических болевых синдромов:
1. Анальгетики
· опиоидные,
· неопиоидные.
2. Адъювантныеанальгетики.
Адъювантные анальгетики (“коанальгетики”)
-гетерогенная группа лекарственных средств, которые обеспечивают анальгезию либопри специфических болевых синдромах, либо нейтрализуют побочные действияопиоидов, что позволяет продлить их анальгетический эффект. К ним относятсялекарственные средства, не обладающие прямыми анальгезирующими свойствами,
ноприобретающими их при определённых обстоятельствах (антигистаминные средства,транквилизаторы, антиконвульсанты и др.). Хроническая (патологическая) больпредставляет собой именно те условия, при которых применение адъювантных средствведёт к положительному эффекту. Среди последних значительное место принадлежитантидепрессантам.
В широкой клинической практике, к сожалению, назначение антидепрессантов врачамимотивируется лишь желанием вызвать седативный эффект и, тем самым, создать благоприятныйфон для основной терапии (анальгетиками). Между тем известно, что применениеантидепрессантов оказывает положительный эффект у 50-60% больных с ХБС. По данныхболее 60 клинических трайлов доказано анальгетическое действие антидепрессантовпри лечении большинства ХБС.
Антидепрессанты оказываютанальгетический эффект по трём основным механизмам :
1. Уменьшаютдепрессию.
2. Потенцируютдействие анальгетиков или эндогенных опиатных пептидов.
3. Обладаютсобственными анальгезирующими свойствами, которые заключаются в длительнойпролонгации синаптической активности норадреналина и серотонина.
Общим показанием для примененияантидепрессантов - ХБС , но некоторые болевые синдромы являются облигатнымпоказанием для их назначения.
К ним относятся :
· нейрогенные болевые синдромы (диабетическая невропатия,герпетическая невропатия, каузалгия и др.),
· некоторые виды первичных головных болей (головная боль мышечногонапряжения, мигрень, абузусная головная боль и др.).
IV. Фармакотерапияантидепрессантами ХБС.
В лечении хронического болевого синдромаприменяются антидепрессанты.
Антидепресанты - ингибиторы нейронального захвата нейромедиаторов:
v неизбирательные;
v избирательные.
К неизирательным антидепресантамотносятся трициклические и четырёхциклические антидепрессанты.
1. Трициклическиеантидепрессанты:
· амитриптилин,
· имипрамин,
· кломипрамин.
Фармакологическое действиепрепаратов этой группы заключается в ингибировании обратного захватанорадреналина и серотонина, что ведёт к накоплению данных нейромедиаторов вобласти рецепторов. Начальная доза трициклических антидепрессантов составляетот 10 до 25 мг вечером, перед сном, с последующим увеличением суточной дозы на10-25 мг каждые 3-7 дней до максимальной, составляющей от 75 мг (мигрень,головные боли напряжения) до 150 мг (нейропатические боли). Анальгетическийэффект возможен к концу первой недели, на 2-3 неделе наступает психотропныйэффект - улучшается настроение, повышается трудоспособность, исчезает тревожноеожидание боли. Лечение длится несколько месяцев с постепенной отменой.
Побочныеэффекты:
a) холинергические:
o сухость во рту,
o неясность и затуманивание зрения,
o запоры,
o задержкамочеиспускания,
o синусовая тахикардия,
o головокружение.
b) гистаминергические:
o сонливость,
o увеличение веса.
c) адренергические:
o ортостатическаягипотензия,
o кардиотоксичность.
2. Четырёхциклические антидепрессанты:
· мапротилин-лудиомил,
· миансерин-леривон.
Характеризуются преимущественнымдействием на норадренергическую трансмиттерную систему. Есть данные о эффективностиМиансерина (Леривона) при леченииголовных болей мышечного напряжения. Препарат обладает седативным эффектом.Миансерин с хорошим эффектом применяется при болях в нижней части спины в дозеот 10 до 30 мг в сутки.
Препараты этой группы отличаются минимальными побочными эффектами:
o сонливость,
o увеличение веса,
o ортостатическая гипотензия.
Селективные ингибиторы обратного захватасеротонина:
§ флуоксетин-прозак,
§ венфлаксин,
§ нефазодон,
§ сертралин-золофт,
§ пароксетин-паксил.
В лечениихронического болевого синдрома роль селективных ингибиторов противоречива ипока существует немного клинических трайлов, доказывающих их эффективность принейрогенных болях. Наиболее известен флуоксетин(прозак) при лечении головных болей: мигрени и, особенно, хроническихголовных болей напряжения. Рекомендовано принимать по 1 капсуле (20 мг) 1 раз всутки в течение 6-8 недель. Хороший эффект по данным отечественных авторов(А.М. Вейн, Т.Г. Вознесенская и др.) был получен у 65% пациентов. Флуоксетинвызывает статистически достоверное уменьшение частоты приступов и ихпродолжительности.
Селективныеингибиторы обладают минимальной антихолинергической и a-дренергичес-
кой блокирующей активностью.
Побочные эффекты:
o тошнота,
o рвота,
o тревожность
o беспокойство,
o сексуальная дисфункция,
o головные боли,
o возбуждение.
В таблице представлены различные группыантидепрессантов, различающихся по механизму своего действия.
Антидепрессанты (тимоаналептики,тимолептики)
Таблица1.
| А. Ингибиторы моноаминооксидазы (МАО) |
|
| а) необратимые ингибиторы МАО: § Nialamid, § Phenelsine | б) обратимые ингибиторы МАО: § Befolum, § Feprosidnin HCL |
| Б. Ингибиторы нейронального захвата: |
|
| а) неизбирательные ингибиторы нейронального захвата: | б) избирательные ингибиторы нейронального захвата: |
2. четырёхциклические антидепрессанты : § Maprotilin, § Mianserin | § Burtriptiline, § Fluoxetin, § Nefazodon, § Paroxetin, § Sertralin, § Venflaxin. |
| В . Антидепрессанты разных групп : § Cephedrinum, § Citalopram, § Tryptophan. |
|
| Г. Препараты других фармакологических групп с антидепрессивным действием: § Ademetionin. |
|
V. Оценка эффективностииспользования антидепрессантов в лечении ХБС.
В ходе обзора современной литературы оприменении антидепрессантов с целью анальгезии (Onghena, Van Houdenhove, 1992)в плацебо - контролируемых исследованиях, известно:
1. среди популяциибольных с ХБС, получающих антидепрессанты, в среднем, эффект встречается у 74%.
2. при использованииантидепрессантов, величина анальгетического эффекта не зависима отпреимущественно органической или психологической основы боли.
3. величинаанальгетического эффекта не зависит от антидепрессивной активности препарата,наличия маскированной депрессии, а также применения антидепрессантов в качествеседативных средств. Вследствие чего, антидепрессанты с более выраженнымседативным эффектом должны быть использованы у пациентов с нарушениями сна дляснижения риска привыкания к гипнотикам.
4. не существуеточевидных преимуществ в выборе антидепрессантов селективного действия(серотонина или норадреналина). Антидепрессанты, обладающие низкойселективностью в ингибировании обратного захвата моноаминов, обладают большиманальгезирующим эффектом.
Соотношение эффективности и осложнений, вызываемыхантидепрессантами (McQuay et al. 1996)
| Хронические болевые синдромы | NNT (number needed to treat) ЧБНЛ - число больных, которых необходимо лечить, чтобы достичь определённого эффекта) |
||
| Уменьшение боли (>50%) | Малые побочные эффекты | Большие побочные эффекты |
|
| Диабетическая нейропатия | 19,6 |
||
| Постгерпетическая невралгия | 19,6 |
||
| Атипичные лицевые боли | |||
| Центральные боли | |||
| Имипрамин | |||
| Дезипрамин | |||
| Комбинированные ТЦА | |||
| Пароксетин | |||
| Флуоксетин | 15,3 | ||
| Миансерин | |||
острая боль эволюционно является защитным механизмом на экзо- или эндогенное повреждение и передаётся ноцицептивной системой
хроническая боль чаще представляет собой неадекватно высокий, продолжительный и стойкий ответ на те или иные повреждающие факторы и может передаваться как ноцицептивно, так и существовать на основе патологической межнейронной циркуляции импульсов преимущественно на центральном уровне - нейропатическая боль.
Исходя из этих представлений, при лечении ноцицептивной боли традиционно используют анальгетики или нестероидные противовоспалительные средства (НПВС). Для терапии нейропатической боли применяют средства , воздействующие на систему нейротрансмиттеров антидепрессанты и противоэпилептические препараты (АД и ПЭП).
У пациентов с нейропатическим болевым синдромом:
имеются жалобы
на жгучие, колющие, стреляющие или ноющие боли, сопровождающиеся дрожью, парестезиями, чувством онемения
характерна аллодиния
– чувство боли, вызываемое нормальными, безболезненными стимулами
боль обычно усиливается
в ночное время или при физических нагрузках
При установлении хронического болевого синдрома (ХБС) (за исключением ХБС ракового происхождения) необходимо определить, какая именно его разновидность (периферическая нейропатическая боль, центральная нейропатическая боль или боль, не связанная с нейропатией) имеется у пациента, что окажет влияние на терапевтическую тактику:
Периферическая нейропатическая боль
Комплексный местный болевой синдром
Нейропатия, вызванная ВИЧ
Идиопатическая периферическая нейропатия
Инфекция
Метаболические расстройства
Алкоголь, токсины
Диабетическая нейропатия
Дефицит нутриентов
Сдавление нерва
Фантомная боль в конечности
Постгерпетическая невралгия
Тригеминальная невралгия и др.
Центральная нейропатическая боль
Рассеянный склероз
Миелопатии
Болезнь Паркинсона
Постинсультная боль и др.
Боль, не связанная с нейропатией, или ненейропатическая (элементы нейропатической боли могут накладываться на основную симптоматику)
Артрит
Остеоартрит
Хроническая поясничная боль
Хроническая шейная боль
Фибромиолгия
Посттравматическая боль и др.
NB!!!
Передача болевых импульсов по спинному и головному мозгу:
осуществляется
при участии возбуждающих и тормозящих нейротрансмиттеров
лимитируется
степенью активности натриевых и кальциевых каналов.
Норадреналин , серотонин и в наибольшей степени гамма-аминомасляная кислота (ГАМК) являются физиологическими ингибиторами болевой передачи.
Антидепрессанты и противоэпилептические препараты снижают выраженность болевого синдрома путём воздействия на указанные нейротрансмиттеры и ионные каналы.
Трициклические антидепрессанты (ТЦА):
воздействуют на болевую передачу на уровне спинного мозга, ингибируя обратный захват норадреналина и серотонина, которые накапливаясь, тормозят передачу болевых импульсов
агонизм в отношении Н1-гистаминовых рецепторов и связанная с этим седация коррелирует с анальгетическим действием ТЦА
Амитриптилин эффективен так же у пациентов с острой болью.
ТЦА удобно разделить на производные вторичного и третичного амина:
вторичные амины
(нортриптилин, дезипрамин) довольно селективно блокируют нейрональный захват норадреналина
третичные амины
(амитриптилин, имипрамин) практически в равной степени ингибируют захват норадреналина и серотонина, а также обладают выраженным холинолитическим действием
«Новые антидепрессанты» венлафаксин и дулоксетин:
ингибируют обратный нейрональный захват норадреналина и серотонина, не воздействуя на другие нейрорецепторы
не обладают холинолитическим действием
Механизм действия бупропиона связан с блокадой обратного захвата дофамина (остальные механизмы действия препарата изучены не до конца).
Противоэпелептические препараты (ПЭП):
угнетают возбуждение в нейронах
усиливают процессы торможения
Эти препараты воздействуют на:
вольтаж-зависимые натриевые и кальциевые ионные каналы
лиганд-зависимые ионные каналы
специфические рецепторы глутамата и N-метил-D-аспартата
возбуждают глициновые и ГАМК-рецепторы
Клиническая эффективность АД и ПЭП при ХБС
Нейропатическая боль
1.Эффективность ТЦА в лечении нейропатической боли подтверждена в клинических исследованиях.
2.Другие АД демонстрируют вариабельный эффект при этой патологии
Неселективные АД или АД с норадренергической активностью обладают наибольшей эффективностью при нейропатической боли.
Амитриптилин и нортриптилин имеют наибольшую доказательную базу из всех АД при терапии нейропатических и ненейропатичеких болевых синдромов.
Эффект ТЦА коррелирует с их антидепрессивным действием.
Препараты с серотонинергической активностью (типа флуоксетина), как правило, неэффективны в терапии ХБС.
3. Традиционно при лечении пациентов с нейропатической болью применяют ПЭП, причём чаще других используется препарат первой генерации карбамазепин, особенно при наличии:
тригеминальной
постгерпетической невралгии
болевого синдрома на фоне диабетической нейропатии
Частота купирования болевого синдрома при тригеминальной невралгии на фоне приёма карбамазепина колеблется, по данным разных авторов, в пределах 58–90%, а при диабетической нейропатии достигает 63%, что наравне с экономической доступностью определяет широкое использование препарата при этих заболеваниях.
4.ПЭП II поколения тоже имеют убедительную базу в плане эффективности при нейропатической боли. В клинических исследованиях габапентин оказался эффективнее плацебо у пациентов с диабетической нейропатией и постгерпетичекой невралгией. Аналогичными свойствами обладает прегабалин.
5. Ламотриджин продемонстрировал эффективность при:
тригеминальной невралгии
невралгии, ассоциированной с ВИЧ-инфекцией
постинсультном болевом синдроме
неспецифической рефрактерной нейропатической боли
Длительное использование ламотриджина во многом ограничивается риском развития опасных для жизни кожных реакций.
6. АД и ПЭП в целом сравнимы по эффективности при ХБС, особенности имеются лишь в использовании и переносимости препаратов внутри этих групп.
Ненейропатическая боль
1. В большинстве случаев при различных ненейропатических болевых синдромах эффективны ТЦА (хотя выраженность их действия может снижаться с течением времени), остальные АД и ПЭП активности при этих состояниях не демонстрируют.
2. АД имеют среднюю степень эффективности в редуцировании выраженности болевого синдрома и беспокойства, улучшении сна и общего состояния больных фибромиалгией.
3. Флуоксетин оказывает значимое действие при болевом синдроме на фоне фибромиалгии в дозе 80 мг/сут и не обладает таковым в дозе 20 мг/сут.
4. Из ПЭП эффективными средствами при фибромиалгии считаются дулоксетин и прегабалин.
5. АД имеют достоверный (но слабый) эффект при хронической поясничной боли. Наименьшее действие оказывают АД с преимущественной серотонинергической активностью.
Сведения о препаратах, которые можно использовать при ХБС
Антидепрессанты
1. ТЦА
Нежелательные побочные реакции (НПР): сухость во рту, запор, задержка мочи, седация, увеличение массы тела
Амитриптилин, имипрамин
10–25 мг; наращивают по 10–25 мг/нед до дозы от 75 до 150 мг на ночь
НПР:Выраженное холинолитическое действие, нельзя использовать в пожилом возрасте
Дезипрамин, нортриптиллин
25 мг утром или на ночь; наращивают по 25 мг/нед до 150 мг/сут
НПР:Менее выраженное холинолитическое действие
2. СИОЗС (селетивные ингибиторы обратного захвата серотонина)
Флуоксетин, пароксетин
10–20 мг/сут, до 80 мг/сут при фибромиалгии
НПР: тошнота, седация, снижение либидо, головная боль, увеличение массы тела; при ХБС эффект слабый
3. «Новые» антидепрессанты
Бупропион
100 мг/сут, нарашивают по 100 мг/нед до 200 мг 2 р/сут
НПР: тревога, инсомния или седация, потеря веса, припадки (при дозе выше 450 мг/сут)
Венлафаксин
37,5 мг/сут, наращивают по 37,5 мг/нед до 300 мг/сут
НПР: головная боль, тошнота, повышенное потооделение, седация, артериальная гипертензия, припадки; серотонинергические эффекты в дозе ниже 150 мг/сут; серотонин- и норадренергические эффекты в дозе выше 150 мг/сут
Дулоксетин
20–60 мг/сут в 1–2 приёма при депрессии, 60 мг/сут при фибромиалгии
НПР: тошнота, сухость во рту, запор, головокружение, инсомния
Противоэпелептические препараты
I поколение
Карбамазепин (Финлепсин)
200 мг/сут, наращивают по 200 мг/нед до 400 мг 3 р/сут (1200 мг/сут)
НПР: головокружение, диплопия, тошнота, апластическая анемия
Фенитоин
100 мг на ночь, дозу наращивают еженедельно до 500 мг на ночь
НПР: тошнота, головокружение, атаксия, невнятная речь, беспокойство, нарушение кроветворения, гепатотоксичность
II поколение
Габапентин
100–300 мг на ночь, наращивают по 100 мг каждые 3 дня до 1800–3600 мг/сут на 3 приёма
НПР: сонливость, утомляемость, головкружение, тошнота, седация, увеличение массы тела
Прегабалин
150 мг на ночь при диабетической нейропатии; 300 мг 2 р/сут при постгерпетической невралгии
НПР: сонливость, утомляемость, седация, головокружение, тошнота, увеличение массы тела
Ламотриждин
50 мг/сут, наращивают по 50 мг каждые 2 нед до 400 мг/сут
НПР: сонливость, запор, тошнота, редко жизнеугрожающие кожные реакции